你正在收集你所有实验中的数据,并准备在年度进度报告时提交给你的顾问和论文委员会。你有一个有趣的假设,你还有一种经验证可在蛋白印迹实验 (WB) 中检测靶蛋白的抗体。该条带的分子量是正确的,并且靶蛋白的表达正如你预测的那样改变。
现在,您知道 — 并且百分之百确定 — 当那张展示幻灯片出现时,委员会中将有人询问关于上样对照问题。
解释蛋白质印迹法数据
无论是设置新一批的 WB 实验,还是解释文献中的 WB 数据,在比较 WB 条带时都应该记住两个问题:
- 泳道是否等量上样?
- 信号是否处于检测的线性范围内?
为了补偿样品变化并确保等量上样,通常以 β-肌动蛋白或 GAPDH 等“管家”蛋白的上样对照形式测定细胞蛋白含量。
相关:应该如何选择上样对照?
上样对照标准化的注意事项
理论上,印迹物上持家蛋白质的量正比于细胞数目,但这是一个可能有误导性的假设,尤其单一蛋白质用于标准化时是这样1。尽管使用单一上样对照司空见惯,但增加种数将导致变异性更小。最好考虑使用 5 种上样对照。2, 3
遗憾的是,上样对照蛋白通常远比目的蛋白富集。当在单一稀释度下测定对照和靶蛋白时,更富集的蛋白的信号可能较为饱和,会超过检测线性动态范围。饱和对照条带不完全报告泳道之间的差异。你可能会理解这个问题如何能强化关于等量上样的假设,从而可能得出关于实验变量的虚假结论!
相关:蛋白质印迹法失败的成本
有时,过量上样和饱和会导致残缺印迹,而不是有序条带,或有“燃尽状”或“凹陷状”中心的条带,表明 HRP 偶联二抗已耗尽化学发光试剂的局部浓度。这可能伴随着膜上有褐色斑点,即过氧化物酶过度活化的一种副产物。
以下显示的是这种现象的一个极端例子:
%20(1)-1.jpg)
但请注意,你的印迹上不存在“怪异”条带或褐色斑点可能并不指示线性信号。即使对照条带显得相当有序,但它们仍可能是饱和的。2
证明上样对照的线性
为了展示上样对照和目的蛋白二者的线性,可在同一个印迹物上加载一系列样品稀释物或同时转移多个印迹物,以避免转移效率变异。2,3 滴定蛋白质输入、一抗和/或化学发光试剂可能对实现获得线性为必需,特别对高表达的上样对照是这样。在下面的例子中,需要更长和更短曝光才足以分别获得 HNF1 和 GAPDH 的线性信号。
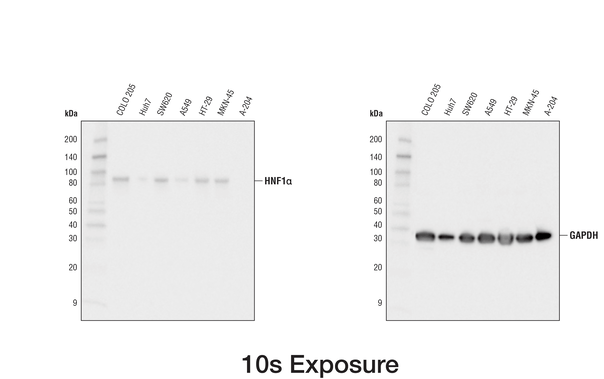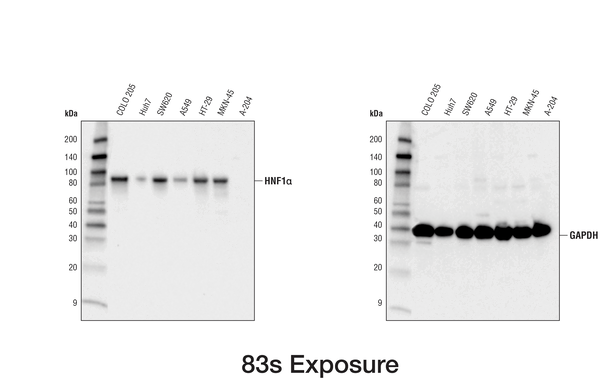
经动画以显示两种曝光,使用 HNF1α (D7Z2Q) Rabbit mAb #89670(左图)或 GAPDH (D16H11) XP® Rabbit mAb #5174(右图)对来自各种细胞系的提取物进行蛋白质印迹分析。
蛋白印迹信号也高度取决于检测方法。与胶片相比,使用电荷耦合器件 (CCD) 相机检测增强型化学发光 (ECL) 可产生出色的线性动态范围。如果数字信号饱和,则可以使用软件设置来显示红色像素。荧光扫描(使用与荧光染料而不是过氧化物酶偶联的二抗)经证实可避免发光化学的固有限制,因而更好。
在设置实验时,这些方法可能意味着更少的梯度稀释次数。但如果你的实验室无法使用最新最好的技术,你也可以使用传统 ECL 和胶片获得较好的数据,但需要你花时间设置实验,以解决等量上样和动态范围问题。
总而言之,使用多个上样对照显然是一个耗费时间和试剂的问题。一种愈加可行的替代方法是测定每个样品泳道中的总蛋白上样量,这是多对照概念的一种逻辑延伸,无需探测多个上样对照。测定总蛋白涉及对每个泳道1 的蛋白条带或至少多个离散条带3 进行染色和扫描。谨慎的做法是确认染色剂不会干扰后续的免疫检测(可能取决于抗体),或者进行二重印迹实验,一个针对总蛋白,另一个针对抗体。
避免常见的 WB 失误
对于许多研究生和博士后,可能觉得进行蛋白印迹实验是“例行常规”。但重要的是,要记住,解释蛋白印迹实验的数据时(对任何实验都一样),细节决定成败。仔细考虑样品制备、转移条件和一抗等问题,将有助于您避免失误。2, 4-5
到了发表的时候,记得提供所有详细信息,以便其他人准确评估结果并重复做实验。换言之,负责地进行印迹实验!
参考文献
- Eaton SL, Roche SL, Llavero Hurtado M, Oldknow KJ, Farquharson C, Gillingwater TH, Wishart TM (2013) Total protein analysis as a reliable loading control for quantitative fluorescent Western blotting. PLos One 8(8):e72457.
- Janes KA (2015) An analysis of critical factors for quantitative immunoblotting. Sci. Signal. 8(371): rs2.
- McDonough AA, Veiras LC, Minas JN, Ralph DL (2015) Considerations when quantitating protein abundance by immunoblot. Am J Physiol Cell Physiol. 308(6):C426-33.
- Ghosh R, Gilda JE, Gomes AV (2014) The necessity of and strategies for improving confidence in the accuracy of western blots. Expert Rev Proteomics. 11(5):549-60.
- Gorr TA, Vogel J. (2015) Western blotting revisited: critical perusal of underappreciated technical issues. Proteomics Clin Appl. 9(3-4):396-405.




 沪公网安备31011502018823号
沪公网安备31011502018823号